Politiche settoriali
Il punto di partenza
Il settore farmaceutico globale è il quarto mercato al mondo in termini di vendite nette e il terzo per profitti complessivi [i]. Il mercato globale dei farmaci (1.200 miliardi di euro nel 2022 a prezzi di fabbrica) dovrebbe crescere fino a 1.900 miliardi di dollari (1.760 miliardi di euro) entro il 2027 [ii]. A lungo termine, l’invecchiamento della popolazione continuerà a stimolare la crescita della domanda.
Il settore farmaceutico contribuisce in modo significativo all’economia dell’UE. Rappresenta il 5% del valore aggiunto all’economia di tutto il settore produttivo – oltre il 20% per il Belgio e la Danimarca nel 2020 [iii]. I prodotti farmaceutici rappresentano quasi l’11% [iv] delle esportazioni dell’UE.
Circa 937.000 persone sono direttamente impiegate nel settore (al quarto trimestre 2023), rispetto alle 680.000 del primo trimestre 2008 [v]. Si stima [vi] che, aggiungendo l’occupazione indiretta generata dal settore, la sua impronta occupazionale sarebbe più che raddoppiata. Il settore offre posti di lavoro altamente qualificati e ben remunerati, con circa il 15% del personale coinvolto in attività di R&S [vii].
Il settore farmaceutico è anche un settore di importanza geostrategica, come dimostrato dalla pandemia COVID-19. La capacità di sviluppare, produrre e somministrare rapidamente vaccini è stata fondamentale per consentire la ripresa economica dell’UE.
L’UE può sfruttare una forte impronta storica nel settore farmaceutico:
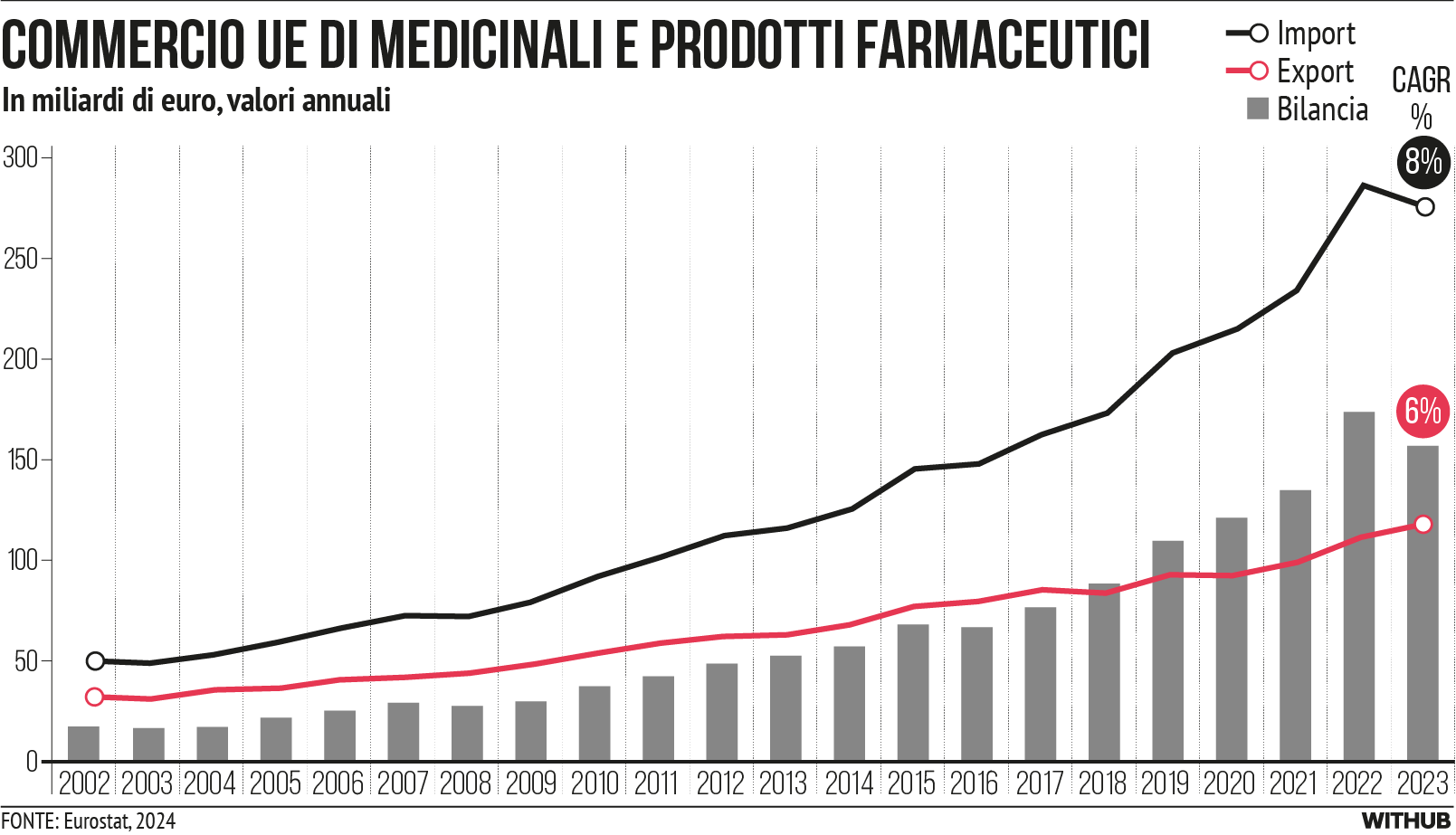
- Una forte presenza negli scambi commerciali. Il settore farmaceutico dell’UE è al primo posto a livello mondiale negli scambi commerciali misurati in termini di valore. Rappresenta esportazioni nette considerevoli e in crescita, che hanno raggiunto il picco nel 2022, in gran parte grazie all’esportazione dei vaccini per COVID-19 [cfr. Figura 1]. Tra il 2002 e il 2023 le esportazioni di prodotti medicinali e farmaceutici dell’UE sono cresciute di quasi il 10% annuo, mentre le importazioni dell’UE sono cresciute dell’8% annuo. Durante l’intero periodo, la bilancia commerciale dell’UE per i prodotti farmaceutici con gli Stati Uniti è stata a favore dell’UE, registrando un surplus di 45 miliardi di euro nel 2023, dopo un picco di 53 miliardi di euro nel 2022.
- Una solida base produttiva e il know-how scientifico nell’ambito dei prodotti brevettati. La solida base produttiva dell’UE nell’ambito dei prodotti brevettati (dimostrata anche dalla sua presenza commerciale globale) è ulteriormente sottolineata dal fatto che la maggior parte dei principi attivi (API) per la produzione di farmaci innovativi nell’UE proviene dall’interno dell’UE stessa (77%) [viii]. In totale, considerando anche i farmaci generici, le importazioni e le esportazioni di API nell’UE sono approssimativamente bilanciate in valore e volume [ix].
- Per quanto riguarda la ricerca, l’UE rimane alla pari con gli Stati Uniti in termini di numero di articoli scientifici pubblicati. Le recenti tendenze mostrano che l’UE sta effettivamente superando gli Stati Uniti in termini di volume di pubblicazioni scientifiche, soprattutto su riviste internazionali. Tuttavia, gli Stati Uniti continuano ad avere un impatto più significativo in termini di citazioni [cfr. Figura 2].
Figura 2 – Fondamentali forti in ambito scientifico
| Pubblicazioni (quote mondiali) | Top 10% pubblicazioni (quote mondiali) | Top 1% pubblicazioni (quote mondiali) | |||||||
| Paese | 2000 | 2010 | 2020 | 2000 | 2010 | 2018 | 2000 | 2010 | 2018 |
| UE-27 | 29% | 26% | 21% | 23% | 24% | 22% | 20% | 23% | 20% |
| Regno Unito | 8% | 6% | 4% | 10% | 8% | 7% | 10% | 8% | 8% |
| Cina | 3% | 9% | 16% | 1% | 5% | 14% | 1% | 3% | 9% |
| Giappone | 9% | 6% | 4% | 5% | 3% | 3% | 3% | 3% | 2% |
| USA | 31% | 26% | 21% | 46% | 40% | 31% | 53% | 48% | 40% |
Fonte: Commissione europea, DG RTD. Sulla base dei dati forniti da Science-Metrix utilizzando il database Scopus.
L’emergente divario di competitività dell’UE
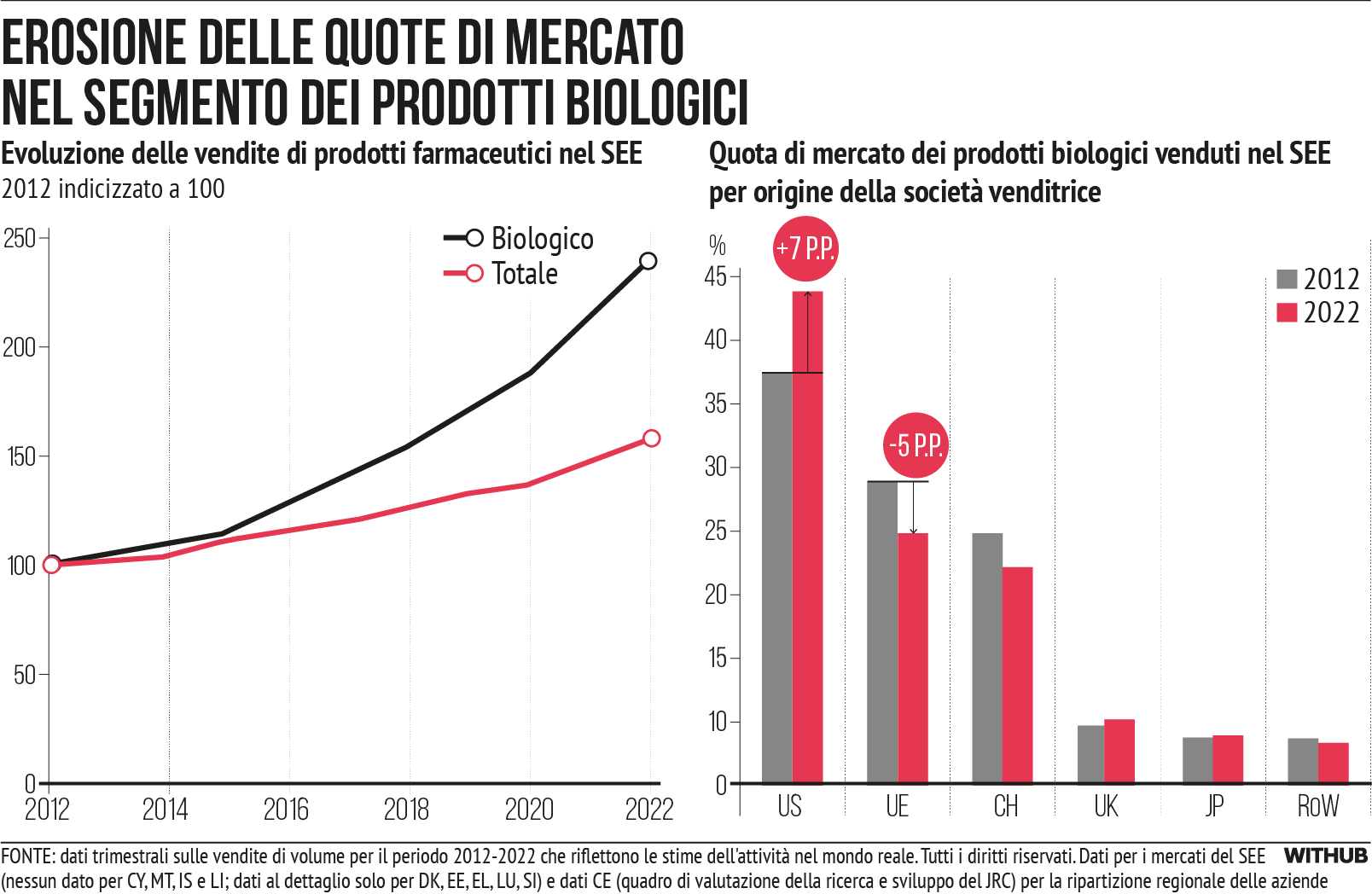
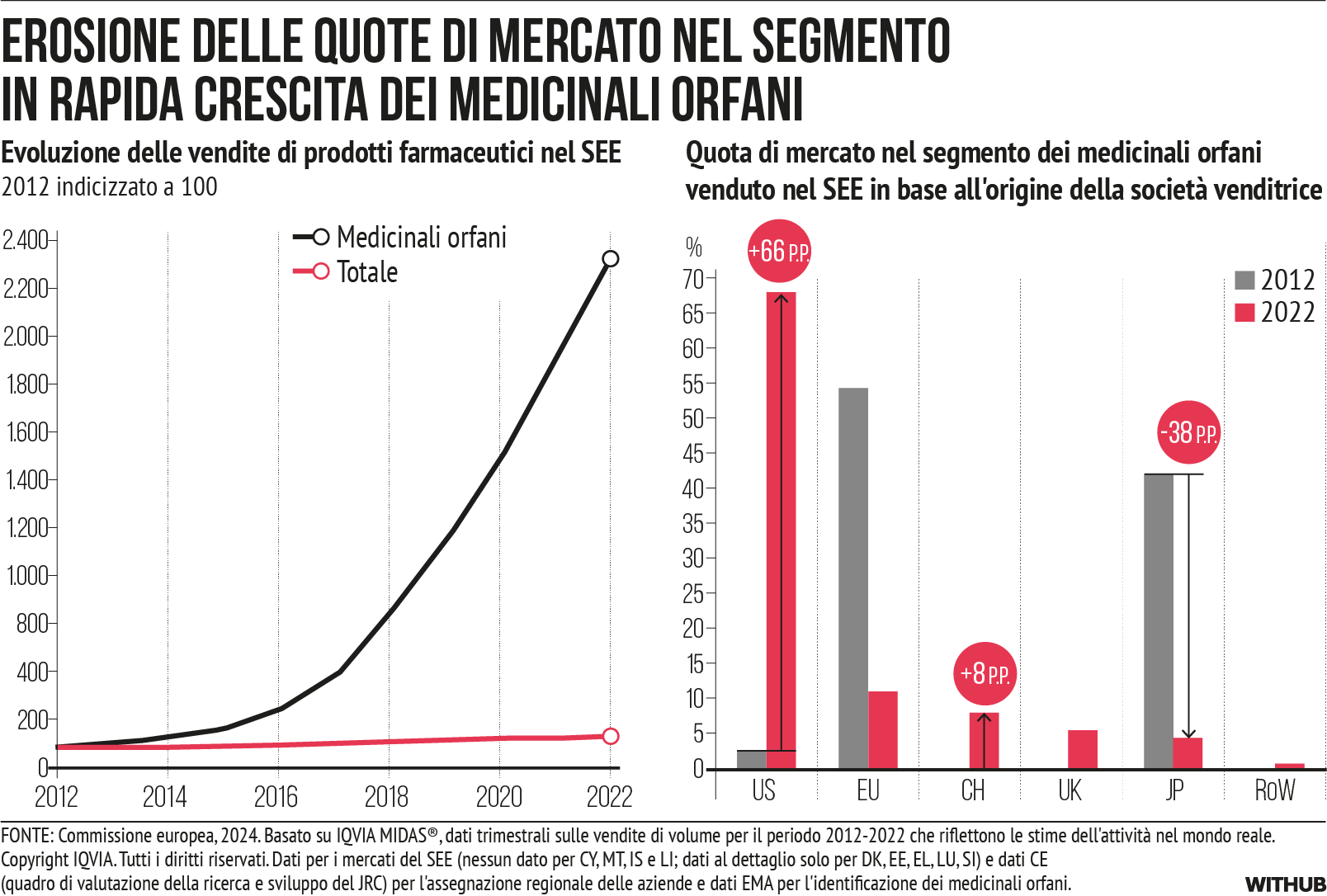
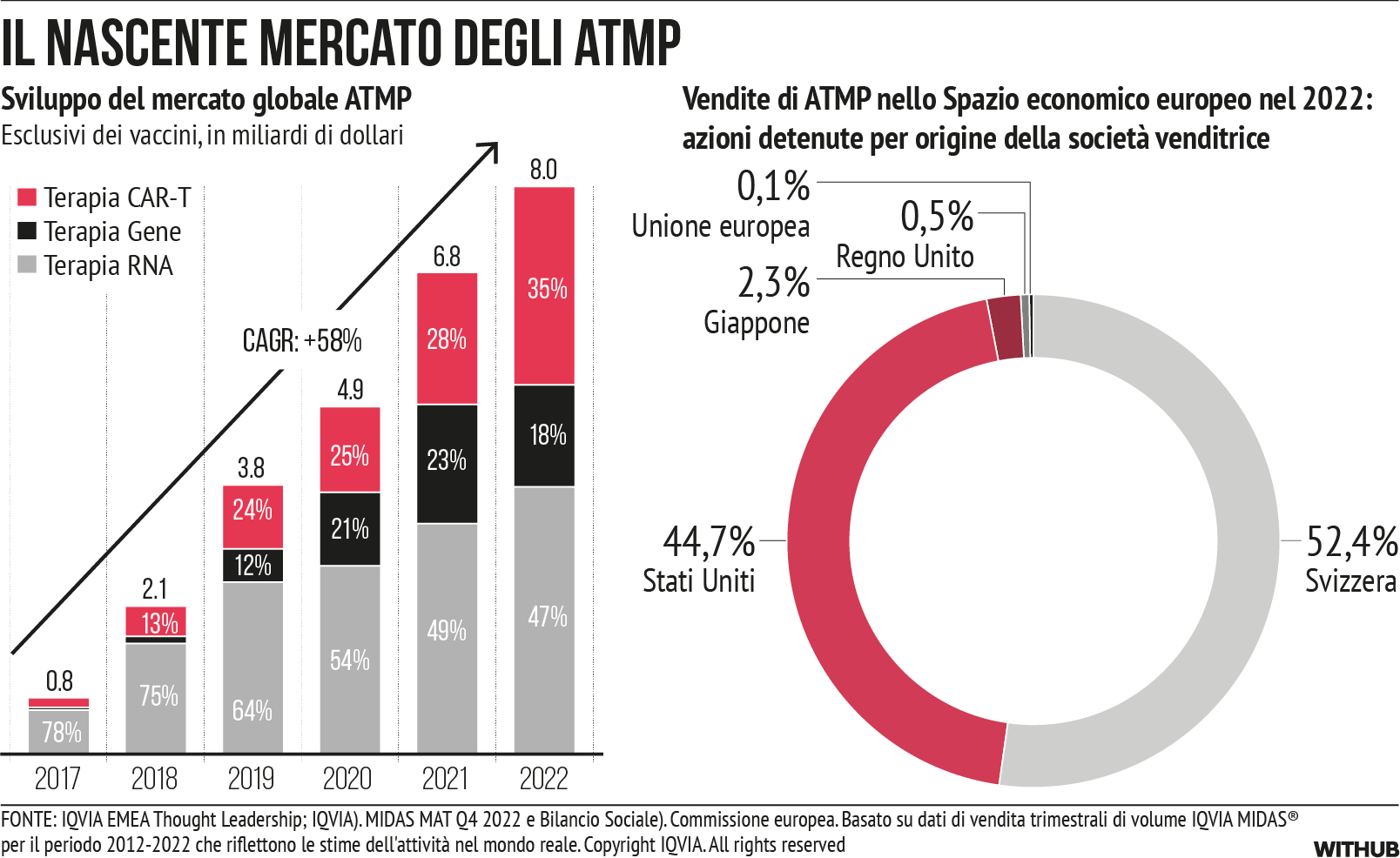
Tuttavia, nell’ultimo decennio i mercati dei prodotti farmaceutici hanno subito trasformazioni. La dimostrazione si basa sui dati delle vendite di prodotti farmaceutici nell’UE (mancano quelli di Malta e Cipro) e in Norvegia. Il mercato dei farmaci biologici continua a crescere in modo dinamico [cfr. Figura 3], insieme a una crescita eccezionale del segmento di mercato dei farmaci orfani [cfr. Figura 4] e dei farmaci basati su geni, tessuti o cellule (medicinali per terapie avanzate (ATMP)) [cfr. Figura 5]. Queste categorie di prodotti si sovrappongono ampiamente. Attualmente, il 55% dei farmaci orfani venduti nell’UE sono biologici e molti ATMP rientrano tra i farmaci orfani.
L’UE sta perdendo terreno in questi segmenti di mercato più dinamici. Dei dieci farmaci biologici più venduti in Europa nel 2022, due sono stati commercializzati da aziende dell’UE, mentre sei (inclusi i primi quattro) sono stati commercializzati da aziende statunitensi [x]. Si nota un netto calo della quota di mercato detenuta dalle aziende dell’UE, a fronte dell’aumento di quella detenuta da aziende statunitensi [cfr. Figura 3].
Dei dieci prodotti più venduti con esclusiva di mercato come farmaci orfani nell’UE/SEE nel 2022, nessuno è commercializzato da aziende con sede nell’UE [xi]. Sette, invece, sono stati commercializzati da aziende con sede negli Stati Uniti. I dati di vendita dei farmaci con status di farmaco orfano nel SEE mostrano un drastico calo per le aziende con sede nell’UE, che passeranno da oltre il 40% del mercato nel 2012 (il Regno Unito da solo rappresentava più del 50%) a meno del 5% nel 2022, mentre gli Stati Uniti rappresentano oggi quasi il 70% del mercato [cfr. Figura 4].
Attualmente, i medicinali per terapie avanzate (ATMP) rappresentano un fatturato globale di circa 8 miliardi di euro. Di questi, 1 miliardo di euro proviene dall’UE/SEE, soprattutto da prodotti commercializzati da aziende con sede negli Stati Uniti e in Svizzera [cfr. Figura 5]. La spesa per gli ATMP a livello mondiale è cresciuta con un tasso di crescita annuo composto (CAGR) del 60% tra il 2017 e il 2022 [xii].
Le cause dell’emergente divario di competitività dell’UE
Il divario competitivo emergente nell’UE è dovuto a molteplici cause, tra cui in particolare:
- Investimenti pubblici in R&S più ridotti e frammentati nell’UE.
- Minori investimenti privati in R&S nell’UE e un ambiente di sostegno più debole.
- Un quadro normativo UE lento e complesso.
- Il complesso emergere di uno Spazio europeo dei dati sanitari (EHDS).
Investimenti pubblici in R&S più ridotti e frammentati nell’UE.
Per quanto riguarda gli investimenti in R&S, si osserva un ampio deficit di finanziamento con gli Stati Uniti, a fronte della crescente presenza della Cina.
Per quanto riguarda gli investimenti pubblici in R&S, gli Stati Uniti si affidano a un bilancio sostanzioso, a una base di sostegno diversificata e a canali di finanziamento centralizzati. Il National Institutes of Health (NIH) è il principale finanziatore, con un budget che supererà i 45 miliardi di dollari annui nel 2023, con oltre l’80% del budget speso in sovvenzioni competitive. Inoltre, l’Agenzia per la ricerca e lo sviluppo avanzati in campo biomedico (BARDA) ha un budget di 823 milioni di dollari per sviluppare contromisure mediche per le emergenze sanitarie. I finanziamenti del governo statunitense sostengono anche la ricerca nelle università, negli istituti di ricerca e negli ospedali, coprendo un’ampia gamma di ricerche di base e applicate. Complessivamente, in termini di spesa pubblica diretta per i programmi scientifici e i bilanci della sanità, la spesa totale degli Stati Uniti raggiungerà circa 47 miliardi di euro nel 2023 (44 miliardi di euro nel 2022, si veda anche sotto) [xiii].
In Cina si osserva una tendenza generale all’aumento dei finanziamenti pubblici per R&S. I dati [xiv] indicano che nel 2020 il finanziamento pubblico della R&S in Cina rappresenterà lo 0,48% del PIL (0,69% nell’UE e 0,74% negli USA), rispetto allo 0,41% del 2010 (0,69% nell’UE e 0,89% negli USA). Per quanto riguarda la R&S per i prodotti farmaceutici, nel 2017 la spesa pubblica in Cina era stimata [xv] pari allo 0,02% del PIL, rispetto allo 0,05% del PIL della spesa pubblica diretta in R&S per la salute nell’UE attraverso programmi e bilanci scientifici [xvi].
A differenza degli Stati Uniti, l’UE fa affidamento a una base di finanziamenti meno ampia, frammentata e meno mirata. Il programma Horizon Europe (2021-2027) stanzia 8,2 miliardi di euro per la ricerca sanitaria, sostenendo la ricerca fondamentale e applicata, e per il sostegno alle piccole imprese e alle start-up. Inoltre, la Direzione-Generale per la preparazione e la risposta alle emergenze sanitarie (HERA) della Commissione europea, di recente istituzione, dispone di un bilancio di circa 5,4 miliardi di euro (2022-2027), attingendo ai programmi dell’UE, tra cui Horizon Europe e EU4Health. HERA si concentra sul miglioramento della preparazione alle crisi di salute pubblica, tra l’altro esplorando soluzioni per superare i fallimenti del mercato nello sviluppo e nella commercializzazione di antibiotici, vaccini e antivirali, sviluppando l’approvvigionamento di contromisure mediche e migliorando i dati sanitari e gli strumenti digitali.
Inoltre, gli Stati membri contribuiscono a livello nazionale finanziando le proprie università e istituzioni di ricerca (ad esempio, la Società Fraunhofer e la Società Max Planck in Germania e l’Istituto nazionale per la sanità e la ricerca medica (INSERM) in Francia). Gli stanziamenti pubblici dell’UE per la ricerca e lo sviluppo (GBARD) nel settore sanitario sono stati di circa 10 miliardi di euro o 0,06% del PIL nel 2022, o 11,2 miliardi di euro e 0,07% del PIL se si include Horizon Europe (44 miliardi di euro e 0,18% del PIL negli Stati Uniti per il 2022) [xvii]. Un Paese come la Danimarca spende lo 0,15% del proprio PIL per la sanità tramite GBARD. D’altra parte, ben nove Stati membri dell’UE spendono lo 0,1% del loro PIL o meno. La frammentazione del sistema rischia di creare duplicazioni e potenzialmente di far emergere progetti meno innovativi.
Minori investimenti privati in R&S nell’UE e un ambiente di sostegno più debole.
Gli Stati Uniti dominano l’UE per quanto riguarda gli investimenti privati in R&S da parte di grandi società multinazionali, per lo più quotate in borsa. Sebbene l’intensità di R&S delle aziende farmaceutiche statunitensi rispetto alle vendite nette (14,5%) sia leggermente superiore a quella delle aziende dell’UE (13,2%), il predominio degli Stati Uniti negli investimenti in R&S è dovuto principalmente alla maggiore presenza complessiva sul mercato delle aziende statunitensi (dimostrata da vendite globali superiori dell’86%). Negli ultimi due decenni, la quota dell’UE nella R&S farmaceutica mondiale è rimasta intorno al 20%, mentre quella degli Stati Uniti si è attestata al 40%. In particolare, il Regno Unito e la Svizzera (CH) hanno registrato un calo di posizione rispetto alla Cina [cfr. Figura 6]. L’aumento dei finanziamenti per la R&S in Cina si riflette anche nella forte crescita, riscontrata negli ultimi anni, dei nuovi farmaci di origine cinese in fase di sviluppo [xviii].
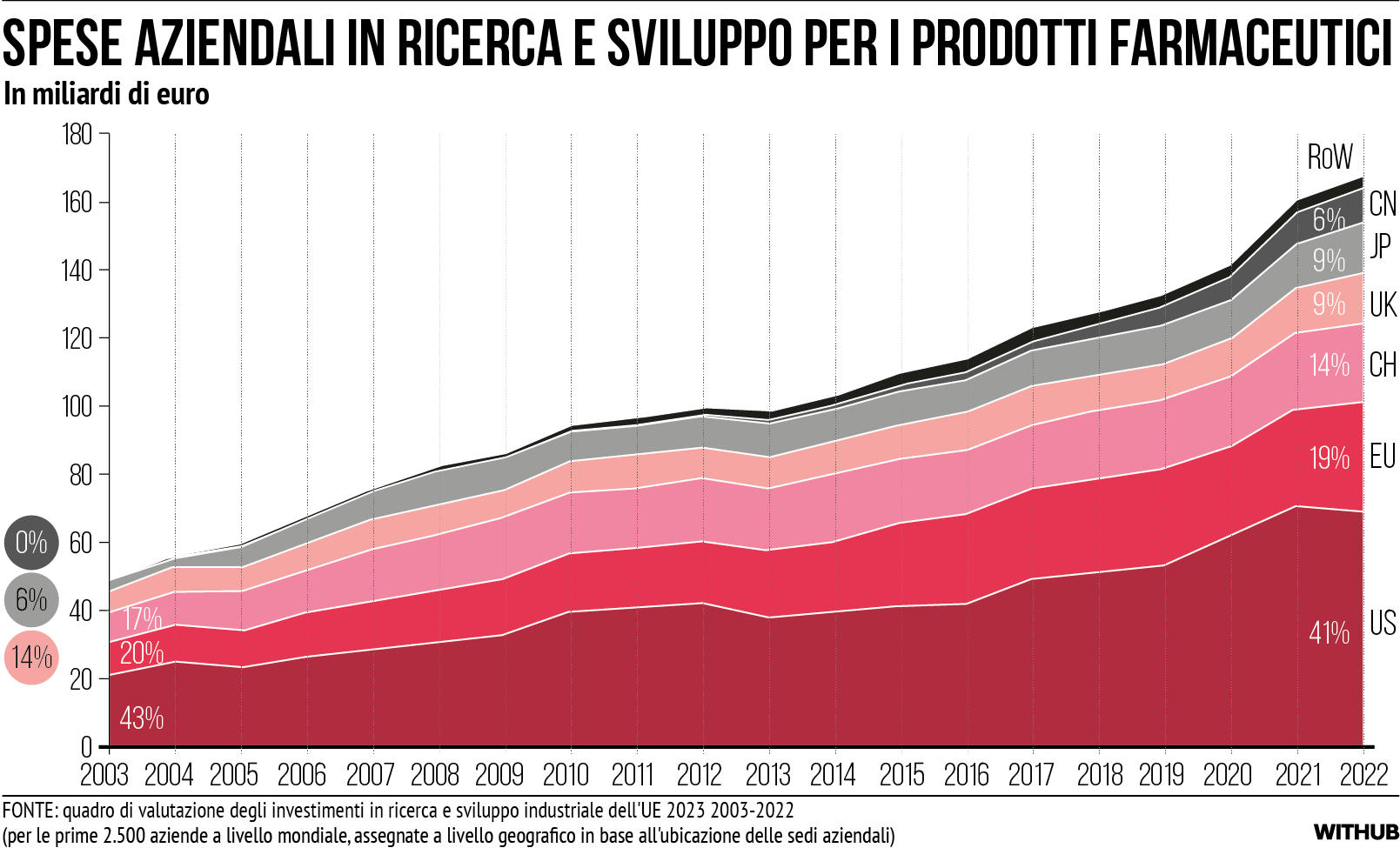
Per quanto riguarda gli investimenti di private equity, il divario tra Stati Uniti e Unione Europea è ancora più ampio. Complessivamente, nel periodo 2021-2022 le aziende biotecnologiche statunitensi hanno ricevuto 62,5 miliardi di dollari di finanziamenti con capitali di rischio, rispetto agli 11,2 miliardi di dollari ricevuti dalle aziende europee [xix]. Questa sfida è particolarmente sentita dalle PMI, che svolgono un ruolo cruciale e in continua crescita nell’ecosistema farmaceutico. Le aziende biofarmaceutiche emergenti rappresenteranno il 59% dei lanci di sperimentazione nel 2021 (rispetto al 29% del 2011), mentre le grandi aziende farmaceutiche rappresenteranno il 28% nel 2021 (rispetto al 59% del 2011) [xx].
Di conseguenza, la spesa totale delle imprese statunitensi in R&S per la fabbricazione di prodotti farmaceutici di base e preparati farmaceutici è circa quattro volte superiore a quella dell’UE, lo 0,45% del PIL per gli Stati Uniti rispetto allo 0,11% per l’UE, come stimato sulla base dei dati OCSE riferiti al 2021 [xxi]. I dati riportati dall’industria [xxii] indicano una differenza simile, anche se meno pronunciata: 69,7 miliardi di euro per gli Stati Uniti e 26,5 miliardi di euro per gli Stati membri dell’UE nel 2021.
Detto questo, a livello europeo ci sono iniziative degne di nota che catalizzano i finanziamenti privati. Ad esempio, per promuovere la capacità di risposta alle future emergenze sanitarie, HERA Invest libera crediti fino a 100 milioni di euro per sostenere le PMI innovative nelle fasi iniziali e finali delle sperimentazioni cliniche. HERA Invest fa parte del Fondo InvestEU gestito in collaborazione con il Gruppo Banca europea per gli investimenti (BEI). Complessivamente, la BEI è il più grande fornitore di debito di rischio per il settore delle scienze della vita in Europa, con un portafoglio di oltre 2,7 miliardi di euro a fine 2023, a sostegno di più di 100 imprese innovative, di cui quasi la metà nel campo delle biotecnologie [xxiii].
I poli di innovazione che uniscono industria, università e investitori non riescono a raggiungere la massa critica nell’UE. I cluster dell’UE – come la BioValley tri-nazionale in Francia, Germania e Svizzera, la Medicon Valley tra Danimarca e Svezia, la BioM in Germania e la FlandersBio in Belgio – non hanno ancora raggiunto la massa critica per rivaleggiare con le dimensioni, l’attrattiva e l’impatto globale dei principali hub statunitensi (nell’area di Boston o nella baia di San Francisco). Ciò è in parte dovuto all’approccio frammentato dell’UE. In genere, gli interessi nazionali degli Stati membri portano a sostenere i campioni locali, dando vita a un panorama dispersivo, piuttosto che concentrarsi sullo sviluppo di pochi hub dedicati e mirati.
Gli Stati Uniti, invece, concentrano il loro sostegno negli hub. Il Massachusetts riceve l’11,4% dei finanziamenti NIH, nonostante rappresenti solo il 2,1% della popolazione statunitense, al fine di dare impulso all’hub dell’area di Boston [xxiv]. Anche la Cina sta attuando politiche per la creazione di hub. Le biotecnologie sono elencate come uno dei dieci settori chiave per lo sviluppo nell’ambito della strategia industriale cinese “Made in China 2025”. La politica statale per lo sviluppo dell’industria biotecnologica si basa su un modello a cluster, dando priorità a tre regioni: l’area di Pechino-Tianjin-Hebei nel nord-est della Cina, il delta del fiume Yangtze incentrato su Shanghai e il delta del fiume Pearl incentrato su Guangzhou e Shenzhen vicino a Hong Kong. Con l’avvento di terapie sempre più personalizzate, e soprattutto degli ATMP, l’integrazione degli hub di innovazione con il resto della catena del valore è destinata a crescere.
BOX 1. Assegnazione delle aziende ai Paesi in un’industria globalizzata – avvertimenti
Assegnare le attività di un’azienda esclusivamente al Paese in cui ha la sede principale non fornisce necessariamente un quadro accurato dell’effettiva localizzazione delle attività industriali e di R&S.
A titolo di esempio, il Belgio ha un alto livello di attività sul proprio territorio da parte di aziende con sede all’estero, come Johnson & Johnson, Pfizer, Novartis e GSK. Nel 2022 gli investimenti in R&S delle imprese locali nel settore farmaceutico sono stati pari a 5,7 miliardi di euro, il secondo importo più alto nell’UE dopo la Germania (9,4 miliardi di euro) [xxv]. Tuttavia, se si assegnano gli investimenti in R&S delle imprese in base alla sede centrale del Paese, il Belgio si colloca solo al quinto posto (con 1,7 miliardi di euro nel 2022) dopo Germania, Francia e Danimarca e Irlanda [xxvi].
La letteratura economica mostra che R&S e produzione tendono a co-localizzarsi, mentre le sedi centrali non esercitano alcun effetto di co-localizzazione sul resto della catena del valore [xxvii]. Tuttavia, per il settore farmaceutico, i dati suggeriscono che l’ubicazione della sede centrale giochi un ruolo importante. Di conseguenza, tutte le prime 20 aziende farmaceutiche a livello mondiale hanno un centro di R&S attivo nel proprio Paese d’origine [xxviii].
Politiche fiscali più uniformi favoriscono le attività di R&S negli Stati Uniti. I sistemi fiscali influenzano in modo significativo le decisioni delle aziende biofarmaceutiche in merito all’ubicazione della sede centrale e dei centri di R&S. Nell’UE, l’assenza di una politica fiscale armonizzata comporta incentivi diversi nei vari Stati membri. Ad esempio, il Belgio offre una deduzione dell’80% sulla ritenuta d’acconto per i dipendenti addetti alla R&S e una deduzione fino all’85% sull’imposta sul reddito da innovazione. L’Irlanda offre invece un’aliquota d’imposta sulle società del 12,5% sul reddito commerciale e un credito d’imposta per la R&S del 25%.
Questi incentivi specifici per Paese contrastano con l’approccio più uniforme degli Stati Uniti, dove gli incentivi federali come il credito d’imposta per la R&S e il credito d’imposta per i farmaci orfani si applicano a livello nazionale. Inoltre, il sistema statunitense prevede il Bonus Depreciation e la Section 179 Expensing, che consentono la deduzione immediata di una parte significativa del prezzo di acquisto di beni aziendali idonei, tra cui le attrezzature per la R&S. Detto questo, esistono ulteriori incentivi a livello di singoli Stati americani. Tra i crediti d’imposta specifici per ogni Stato si segnalano il Competes Tax Credit della California e il Life Sciences Tax Incentive Program del Massachusetts, quest’ultimo a beneficio delle aziende situate nell’area di Boston.
L’UE ha un quadro normativo sui farmaci lento e complesso.
I tempi di approvazione di nuovi farmaci nell’UE/SEE secondo le procedure dell’Agenzia europea per i medicinali (EMA) sono più lunghi rispetto a quelli delle agenzie regolatorie di altre regioni. I dati riportano [xxix] che il tempo mediano di approvazione per le agenzie regolatorie nel 2022 è stato di 322 giorni in Giappone, 334 giorni negli Stati Uniti, 347 giorni in Australia, 351 giorni in Canada e 418 giorni in Svizzera, rispetto ai 430 giorni nell’UE/SEE.
Inoltre, gli operatori del settore riferiscono che, rispetto alla Food and Drug Administration (FDA) statunitense, l’EMA offre meno opportunità di interazione diretta e strutturata sui pareri scientifici. Inoltre, la necessità di interagire con più comitati dell’EMA rende complesso il quadro dell’UE. Le complessità derivano anche dai collegamenti tra la legislazione farmaceutica generale e altri atti legislativi dell’Unione europea [xxx].
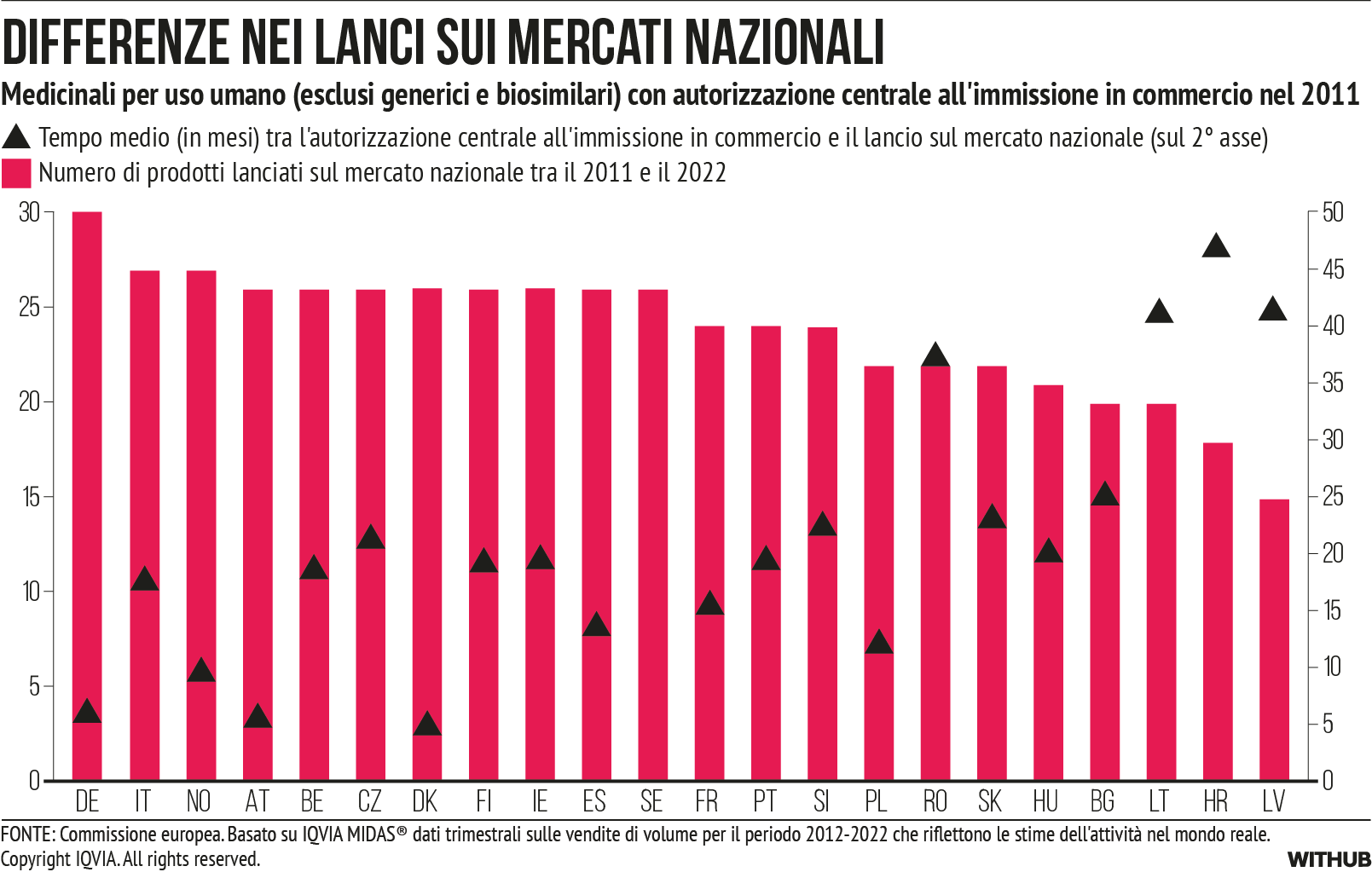
Una volta che un nuovo farmaco è stato approvato dall’EMA, ci sono 27 diverse procedure per stabilire i prezzi e i rimborsi nazionali. Si osservano ampie differenze nell’UE e una quota considerevole di prodotti viene lanciata solo in un numero limitato di mercati [cfr. Figura 7]. A livello internazionale, Giappone e Germania sono i primi Paesi a lanciare dopo gli Stati Uniti, con un ritardo medio di circa un anno [xxxi].
Un elemento critico di queste decisioni è la valutazione nazionale delle tecnologie sanitarie (HTA), che solitamente informa le decisioni di rimborso a livello nazionale. Spesso sono necessari ulteriori dati per dimostrare l’efficacia di un prodotto rispetto all’attuale trattamento rimborsato a livello nazionale. Questo processo è frammentato e richiede tempo, in particolare rispetto all’attuale assetto degli Stati Uniti, dove Medicare (il principale pagatore pubblico di farmaci) copre in larga misura i farmaci approvati dalla FDA.
BOX 2. Quadri nazionali di determinazione dei prezzi e dei rimborsi degli Stati membri dell’UE
Le decisioni sulla determinazione dei prezzi e sul rimborso (P&R) delle cure farmaceutiche rientrano nella sfera di competenza delle autorità nazionali dell’UE ai sensi dell’Articolo 168 (7) del TFUE (il “Trattato di Lisbona”). Le aziende farmaceutiche possono ovviamente prendere decisioni unilaterali che influenzano l’accessibilità delle loro tecnologie. L’inclusione di nuovi prodotti nel paniere dei servizi coperti richiede solitamente che entrambe le parti negozino le condizioni per l’ingresso di un prodotto in un mercato.
Inoltre, le decisioni nazionali di P&R sono soggette alle norme del Trattato sulla Libera circolazione delle merci e ai requisiti procedurali definiti nella “Direttiva sulla trasparenza” (89/105/CEE). La Direttiva definisce principalmente gli obblighi procedurali per gli Stati membri, al fine di garantire alle aziende farmaceutiche decisioni tempestive, motivate e impugnabili in merito alla P&R dei loro prodotti. In particolare, impone agli Stati membri di emettere una decisione sui prezzi entro 90 giorni (se gli Stati membri decidono solo sui prezzi), di fissare un limite di 90 giorni per le decisioni sui rimborsi (se gli Stati membri decidono solo sui rimborsi) e di fissare un limite di 180 giorni per le decisioni congiunte relative alla P&R. Tuttavia, è possibile che si applichino dei “clock stop” a prolungamento delle eventuali tempistiche.
Il panorama della P&R nell’UE è frammentato e ciò comporta una diffusione disomogenea dei nuovi farmaci negli Stati membri. Nell’UE i farmaci vengono commercializzati prima in Stati membri, come Svezia, Danimarca, Austria e Germania. Il quadro normativo tedesco in materia di P&R prevede un periodo iniziale di sei mesi di “free pricing”, al termine del quale il governo prenderà una decisione in materia di P&R sulla base di una valutazione costi-benefici del nuovo farmaco [xxxii]. L’approccio tedesco è ad alta intensità di risorse, in quanto richiede la capacità del governo di condurre Valutazioni delle tecnologie sanitarie (HTA) che confrontino i costi e gli effetti clinici delle varie terapie per valutare il rapporto qualità-prezzo dei nuovi farmaci. La discrezionalità delle aziende nel fissare i prezzi dei prodotti ad libitum durante il periodo iniziale di avvio deve essere articolata, poiché i medici che li prescrivono sono soggetti a restrizioni che garantiscono un uso razionale delle risorse. La Svezia, un altro Paese che ha adottato rapidamente il sistema, applica un approccio più comunemente visto in tutti gli Stati membri dell’UE. Il comitato svedese per i rimborsi decide dell’inclusione dei nuovi prodotti nel paniere dei servizi assicurati sulla base delle evidenze cliniche e della documentazione economica sanitaria fornita dalle aziende farmaceutiche [xxxiii]. In generale, il time to market è fortemente (inversamente) correlato all’entità del bilancio sanitario degli Stati membri per abitante.
Il complesso emergere di uno Spazio europeo dei dati sanitari (EHDS).
[xxxiv]
Esiste un notevole potenziale non sfruttato per fare leva sui dati sanitari nell’UE, come dimostrano le notevoli possibilità di accesso e di collegamento tra le serie di dati nel settore sanitario rispetto agli Stati Uniti.
Attualmente, il GDPR consente il trattamento dei dati sanitari per la fornitura di assistenza sanitaria o sociale, per la salute pubblica e per finalità scientifiche basate sul diritto dell’UE o nazionale. I dati possono essere trattati senza consenso esplicito, a condizione che vengano adottate misure adeguate e specifiche per salvaguardare i diritti e le libertà degli interessati. Alcuni Stati membri beneficiano già di queste possibilità in base alla relativa legislazione nazionale.
Tuttavia, l’adozione di queste opzioni da parte degli Stati membri non è stata uniforme e ha portato a un uso secondario inefficace dei dati sanitari. Per superare questa sfida, la Commissione ha proposto un regolamento che consenta di creare uno Spazio europeo dei dati sanitari (EHDS) basandosi sulle possibilità offerte dal GDPR per una legge europea specifica con particolari garanzie. Nella primavera del 2024, il Parlamento europeo e il Consiglio hanno raggiunto un accordo politico sulla proposta di regolamento. La proposta mira a sviluppare un quadro europeo ispirato alle azioni intraprese da diversi Stati membri che hanno adottato una legislazione nazionale simile per l’uso secondario dei dati sanitari.
Riforme e proposte recenti
Le recenti riforme, azioni e proposte a livello europeo di ulteriore riforma del panorama normativo mirano a stimolare l’innovazione e a semplificare le regole. Sono tuttavia necessari sforzi maggiori.
Dopo l’istituzione dell’Agenzia europea per i medicinali (EMA) nel 1995, per essere commercializzati nell’UE la maggior parte dei farmaci innovativi passa attraverso la procedura di autorizzazione centralizzata supervisionata dall’EMA. Le recenti proposte mirano a modernizzare e semplificare il quadro normativo per l’autorizzazione di nuovi farmaci.
BOX 3. L’Agenzia europea per i medicinali (EMA) e la procedura di Autorizzazione centralizzata di immissione in commercio
L’EMA è stata istituita nel 1995 per armonizzare il lavoro degli organismi nazionali di regolamentazione dei farmaci esistenti. L’EMA supervisiona le autorizzazioni all’immissione in commercio concesse secondo la “procedura centralizzata” con decisione adottata dalla Commissione europea. La procedura centralizzata consente al titolare dell’autorizzazione all’immissione in commercio di commercializzare il farmaco e di metterlo a disposizione dei pazienti e degli operatori sanitari in tutta l’UE/SEE sulla base di un’unica autorizzazione all’immissione in commercio.
La procedura centralizzata è obbligatoria per i prodotti derivati dalla biotecnologia (ad es. biologici), i farmaci orfani, i medicinali per uso umano che contengono un principio attivo autorizzato nell’UE dopo il 20 maggio 2004 e che sono destinati al trattamento di AIDS, cancro, disturbi neurodegenerativi o diabete.
Il 26 aprile 2023 la Commissione europea ha adottato una proposta per una nuova direttiva e un regolamento che rivedono e sostituiscono la normativa farmaceutica generale esistente. In particolare, la proposta prevede un quadro normativo moderno e semplificato, con un’autorizzazione più rapida dei nuovi farmaci. Secondo la proposta, l’EMA avrebbe a disposizione 180 giorni invece di 210 per condurre la sua valutazione. Per l’autorizzazione, la Commissione disporrebbe di 46 giorni anziché di 67. Il quadro semplificato contribuirebbe a ridurre l’attuale media di circa 400 giorni tra la presentazione e l’autorizzazione al mercato. Per la valutazione dei farmaci di maggiore interesse per la salute pubblica, l’EMA avrebbe a disposizione 150 giorni.
Altre misure presentate nella proposta includono spazi di sperimentazione normativa a sostegno dello sviluppo di farmaci innovativi e di farmaci sviluppati da PMI (consentendo una consulenza scientifica più tempestiva), trasmissione elettronica e foglietti illustrativi elettronici [xxxv]. La proposta mira anche a semplificare le regole per la sperimentazione clinica di farmaci costituiti da o contenenti organismi geneticamente modificati (OGM), in modo da facilitare la R&S sugli ATMP nell’UE.
Nel gennaio 2022 è entrato in vigore il Regolamento sulle sperimentazioni cliniche, che mira a creare un ambiente più favorevole nell’UE per lo svolgimento di ricerche su larga scala in ambito clinico. In base al Regolamento, la piattaforma Sistema informativo sulle sperimentazioni cliniche (CTIS) è stata lanciata nel gennaio 2022 per consentire agli sponsor delle sperimentazioni cliniche di presentare domande uniche e semplificate per le sperimentazioni cliniche nazionali o condotte in più Paesi. Sulla base del Regolamento, la Commissione, insieme ai responsabili delle Agenzie per i medicinali e dell’EMA, ha lanciato l’iniziativa di Accelerazione delle sperimentazioni cliniche nell’UE (ACT EU) per integrare meglio la ricerca clinica nel sistema sanitario europeo attraverso dieci azioni prioritarie (fino al 2026). Inoltre, il progetto COMBINE [xxxvi], lanciato nel 2023, mira ad analizzare le cause alla radice del crescente numero di sfide incontrate durante la conduzione di studi clinici che prevedono la combinazione di farmaci e dispositivi medici o diagnostici in vitro.
A partire dal gennaio 2025, il Regolamento dell’UE sulle valutazioni delle tecnologie sanitarie (HTA) (adottato nel 2021) dovrebbe garantire un aumento dell’efficienza nella fase di preparazione delle decisioni nazionali sui prezzi e sui rimborsi e facilitare un accesso più rapido ai farmaci. Questo obiettivo sarà raggiunto mettendo in comune la valutazione clinica dei prodotti da utilizzare nelle HTA nazionali. Entro dicembre 2024 è prevista l’adozione di una serie di atti di esecuzione per il regolamento HTA che riguardano aspetti chiave, come la portata dei dati considerati per i parametri di input delle valutazioni cliniche congiunte dei medicinali.
Il Regolamento EHDS intende contribuire a sbloccare i dati sanitari per la ricerca e l’innovazione (uso secondario). L’EHDS consentirà a ricercatori e innovatori di accedere a cartelle cliniche anonime e pseudonimizzate di tutta l’UE. L’accesso ai dati sanitari è un prerequisito per l’ulteriore sviluppo dell’IA. È importante notare che l’azione proposta per migliorare la condivisione delle cartelle cliniche elettroniche mira ad affrontare la frammentazione tra gli Stati membri dell’UE.
L’uso di “evidenze reali” può contribuire a snellire il processo di reclutamento dei pazienti e di raccolta dei dati per la determinazione di prezzi e rimborsi. Un esempio di come i dati del mondo reale possano essere applicati a livello europeo è il Data Analysis and Real World Interrogation Network (DARWIN EU®). DARWIN EU® è stato istituito nel 2022 dall’EMA e dalla Rete europea di regolamentazione dei medicinali come centro di coordinamento per fornire evidenze tempestive e affidabili da database sanitari reali in tutta l’UE sull’uso, la sicurezza e l’efficacia dei farmaci. Entro la fine del 2023, sedici studi [xxxvii] sono stati completati nell’ambito di DARWIN.
Un’altra iniziativa allineata con l’EHDS è la 1+ MillionGenomes [xxxviii] (1+MG) e la sua iniziativa di follow-up a lungo termine Beyond 1 Million Genomes (B1MG). Entrambe le iniziative mirano a consentire un accesso sicuro ai dati genomici per migliorare la ricerca, l’assistenza sanitaria personalizzata e la definizione delle politiche sanitarie. B1MG si impegnerà in tal senso istituendo l’Infrastruttura europea di dati genomici entro la fine del 2026. L’infrastruttura consentirebbe alle reti nazionali di condivisione dei dati (con partner del mondo accademico e dell’industria) di collegarsi a una rete internazionale in cui i dati rimarrebbero archiviati localmente, ma accessibili in tutta Europa. Utilizzando questo strumento, scienziati e medici potranno accedere alle enormi quantità di dati genotipici e fenotipici collegati tra i 25 Paesi europei (Norvegia compresa) che partecipano al progetto.
BOX 4. Casi di utilizzo dell’IA nei settori sanitario e farmaceutico
L’intelligenza artificiale (IA) rivoluzionerà e sconvolgerà il settore sanitario in modo radicale. In particolare, i casi d’uso dei cosiddetti “prodotti combinati” (prodotti terapeutici e diagnostici che combinano farmaci, dispositivi e componenti biologici) a integrazione dei sistemi di somministrazione dei farmaci con algoritmi di IA (che elaborano i dati di feedback in tempo reale) promettono di fornire terapie più precise e personalizzate ai pazienti in Europa e non solo.
La spesa annuale dell’UE per l’IA nel settore sanitario e farmaceutico è stata stimata a 2,6 miliardi di dollari nel 2022, meno rispetto al Nord America (4,7 miliardi di dollari) e dell’Asia-Pacifico (2,3 miliardi di dollari). Nei prossimi anni la spesa globale è destinata a crescere a un tasso annuo superiore al 40% [xxxix]. Sebbene la promessa dell’IA in questo campo sia solo agli inizi, l’impatto sulla vita dei pazienti è già visibile, così come i segni tangibili del suo enorme potenziale. Ciò va ben oltre l’aumento della produttività dei ricercatori e dei referenti sanitari (ad esempio, automatizzando attività ripetitive e dispendiose in termini di tempo, come la creazione di documenti e la tenuta di registri). L’IA è in grado di potenziare notevolmente la capacità degli operatori sanitari di fornire qualità e precisione, svolgendo compiti e ottenendo risultati che le persone da sole non potrebbero raggiungere [si veda il Box sui casi d’uso verticali dell’IA nel capitolo sulle tecnologie digitali e avanzate: Un progetto per lo sviluppo di casi d’uso verticali dell’IA in tutta l’UE]. Ad esempio:
- L’IA sta già facendo incredibili passi avanti nella diagnosi medica. L’uso dell’IA e del machine learning è già diventato una pratica medica accettata nell’interpretazione di alcuni tipi di immagini medicali [xl]. Il potenziale per un’ulteriore diffusione è elevato. Ad esempio, una rete neurale addestrata (una forma complessa di machine learning) è in grado di classificare le fratture dell’anca con il 19% di precisione in più rispetto a un osservatore umano esperto in un contesto clinico. Poiché la classificazione è altamente determinante per il trattamento, una maggiore accuratezza porta a un trattamento migliore, a migliori risultati per i pazienti e a costi inferiori [xli].
- L’IA può essere applicata a tutto il ciclo di vita dei farmaci. Questo porta a una più rapida scoperta di nuovi composti con potenziali applicazioni medicinali [xlii] e a un più rapido sviluppo di farmaci attraverso sperimentazioni cliniche sull’uomo e a una migliore comprensione delle malattie (ad esempio, applicando il sequenziamento dell’intero genoma per la segmentazione dei gruppi di pazienti per il cancro al fine di indirizzare lo sviluppo di nuove terapie). L’impiego dell’IA per aiutare a curare più malattie in modo più rapido potrebbe liberare ulteriori risorse in aree attualmente non servite. Le iniziative imprenditoriali mirano a ridurre i tempi di scoperta che, oltre a portare più velocemente i trattamenti ai pazienti, hanno il potenziale di espandere il valore del mercato farmaceutico aumentando l’effettiva protezione dei brevetti per i nuovi farmaci. I risparmi sui costi derivanti dalle applicazioni dell’IA dalla fase di scoperta a quella preclinica sono stimati al 25-50% [xliii]. In particolare, i guadagni di efficienza nelle sperimentazioni cliniche di fase III (la fase di R&S più costosa) possono determinare una riduzione dei costi di R&S. Si stima un guadagno di 60-110 miliardi di dollari all’anno grazie all’utilizzo dell’IA nel settore farmaceutico e dei dispositivi medici.
- L’IA generativa può aiutare a personalizzare le terapie. Ciò può essere ottenuto, ad esempio, analizzando i dati dei pazienti e i risultati clinici per ottimizzare i piani di trattamento. La capacità di generare intuizioni e modelli da grandi quantità di dati dei pazienti darà vita a trattamenti più personalizzati e a risultati migliori per i pazienti. Gli strumenti di IA generativa potrebbero anche rendere più coerente l’assistenza ai pazienti, riducendo le deviazioni nella produzione e nella consegna dei farmaci.
Allo stesso tempo, il miglioramento della qualità dell’assistenza sanitaria dovrà essere conciliato con l’equità dei pazienti e con bilanci sanitari sostenibili [xlv]. Inoltre, saranno necessari diversi elementi chiave per promuovere i casi d’uso verticali dell’IA nei settori sanitario e farmaceutico dell’UE. I dirigenti dovranno affrontare difficili decisioni strategiche e sfide operative in un panorama inesplorato, caratterizzato da una tecnologia in rapida evoluzione e da rischi emergenti. Gli esempi includono:
- Accesso a dati di qualità per addestrare gli algoritmi. L’IA generativa non può dare risultati senza un’adeguata architettura dei dati. Le aziende dovranno costruire un livello di intelligenza in grado di comprendere aspetti quali le strutture molecolari, le operazioni cliniche e i dati dei pazienti. Sarà necessario un approccio su più fronti per creare un’infrastruttura di dati per gestire insiemi di dati interni ed esterni. Non si tratta solo di una questione tecnica. I data scientist dovranno collaborare strettamente con i leader della strategia aziendale, degli affari medici e degli aspetti legali e di rischio per stabilire le priorità ed eseguire le strategie. Per quanto riguarda la necessità di dati sui pazienti, la digitalizzazione dei sistemi sanitari è un fattore chiave per sfruttare appieno l’EHDS. I sistemi sanitari dell’UE vengono gradualmente digitalizzati, ma c’è ancora un grande potenziale per la completa digitalizzazione del sistema sanitario entro il 2030. Ad esempio, la percentuale di individui che accedono alle cartelle cliniche online è passata da circa il 10% nel 2020 al 24% nel 2022. Tuttavia, vi è un’ampia divergenza tra gli Stati membri, con la Finlandia che si avvicina all’80%, mentre la Germania si ferma al 2% nel 2022.
- Quadri normativi di sostegno. Ciò include strutture per l’addestramento e la convalida degli algoritmi di IA, la garanzia della sicurezza dei pazienti e il rispetto della riservatezza e della sicurezza dei dati. In effetti, i modelli di IA generativa rappresentano solo il 15% circa del lavoro di un progetto tipico. La maggior parte del lavoro consiste nell’adattare i modelli alla base di conoscenze e ai casi d’uso interni all’azienda. Ciò è particolarmente vero per l’industria farmaceutica, data la complessità dei suoi dati e l’unicità delle sue normative e tecnologie.
- Una forza lavoro qualificata. La disponibilità di un numero sufficiente di data scientist, specialisti di IA, esperti di bioinformatica e professionisti esperti di farmaceutica e IA è un fattore importante. Inoltre, per riuscire a implementare l’IA generativa, le aziende devono avere le competenze necessarie per integrarla in flussi di lavoro complessi per promuoverne l’adozione e l’impatto. Ad esempio, il 70% delle trasformazioni digitali può fallire non a causa di problemi tecnici, ma perché i leader del settore sanitario hanno ignorato l’importanza di gestire il cambiamento.
- R&S orientata al mercato. Gli sforzi di cooperazione tra start-up, aziende più grandi, gruppi di ricerca e fornitori di assistenza sanitaria potrebbero alimentare l’innovazione dirompente e accelerare l’adozione dell’IA. In futuro, il sostegno finanziario alle start-up e ai gruppi di ricerca attivi nella RS&I dirompente o nello sviluppo di nuove applicazioni hardware specifiche nel campo della salute potrebbe essere offerto sotto forma di bandi di gara per progetti (“sfide”) nel contesto di partenariati pubblico-privato che riuniscano attori pubblici e aziende attive nel settore farmaceutico e aziende attive nel campo dell’IA.
Obiettivi e proposte
L’obiettivo generale è mantenere ed espandere la capacità di R&S dell’UE. In questo modo, le decisioni relative alle località di produzione possono essere influenzate positivamente, ad esempio nel settore dei prodotti farmaceutici interessati da brevetto. Un’attenzione particolare è rivolta ai prodotti biologici, ai prodotti orfani e ai medicinali per terapie avanzate (ATMP). Per quanto riguarda quest’ultimo gruppo – il nascente mercato degli ATMP – si persegue la leadership mondiale dell’UE nel campo della R&S.
Le proposte mirano ad affrontare le cause principali che determinano l’emergente divario di competitività dell’UE nel settore farmaceutico. Per colmare questo divario si raccomandano le seguenti azioni, anche sulla base di recenti riforme e proposte. Inoltre, le proposte 1 e 2, così come la 4, attireranno in particolare nuove attività di R&S nell’UE. Le proposte da 3 a 5 contribuiranno ad accelerare l’accesso ai mercati per i prodotti. Le proposte 7 e 8 riguardano direttamente le opzioni per un finanziamento maggiore e più mirato in materia di R&S. Infine, le proposte 6 e 9 mirano a promuovere la prevedibilità delle imprese nel lungo periodo.
Queste proposte sono integrate da proposte provenienti da vari altri capitoli, in particolare i capitoli Innovazione, Sostegno agli investimenti e Governance.
| Figura 8. TABELLA RIASSUNTIVA – PROPOSTE FARMACEUTICHE | ORIZZONTE TEMPORALE [nota 1] | |
| 1 | Massimizzare l’impatto dello Spazio europeo dei dati sanitari, ad esempio facilitando l’accesso e la condivisione delle cartelle cliniche elettroniche, sfruttando la rete DARWIN EU® e aumentando le capacità di sequenziamento del genoma. | BT/MT |
| 2 | Semplificare l’impostazione e la gestione delle sperimentazioni multinazionali nell’UE per far sì che l’UE diventi un luogo attraente per la conduzione di attività di R&S clinica. | MT |
| 3 | Accelerare l’accesso ai mercati attraverso un’azione coordinata delle agenzie del farmaco, delle autorità HTA e dei pagatori pubblici in materia di orientamento all’industria, prezzi e rimborsi, nonché di approvvigionamento. | MT |
| 4 | Fornire indicazioni chiare e tempestive sull’uso dell’IA nel ciclo di vita dei farmaci. | MT |
| 5 | Attuare rapidamente e pienamente il regolamento HTA e garantire l’assegnazione delle risorse necessarie per assicurare la realizzazione di valutazioni cliniche congiunte a partire dal 2025, con l’obiettivo di istituire un’agenzia dell’UE nel lungo termine. | BT/LT |
| 6 | Migliorare la prevedibilità delle imprese attraverso un dialogo continuo e basato su dati concreti con le parti interessate per sostenere il processo decisionale dell’UE sui meccanismi di protezione dei nuovi farmaci. | MT/LT |
| 7 | Aumentare e concentrare gli investimenti pubblici in R&S nell’UE, ad esempio sostenendo una serie di hub di innovazione di livello mondiale nelle scienze della vita per i medicinali per terapie avanzate (ATMP). | MT |
| 8 | Mobilitare gli investimenti privati in R&S nell’UE e rafforzare l’ambiente di sostegno. | MT |
| 9 | Sviluppare partenariati internazionali strategici per consolidare e rafforzare la posizione commerciale internazionale dell’UE nel settore farmaceutico. | MT/LT |
NOTA 1. L’orizzonte temporale è indicativo del tempo necessario per l’attuazione della proposta. Il breve termine (BT) si riferisce a circa 1-3 anni, il medio termine (MT) a 3-5 anni, il lungo termine (LT) oltre i 5 anni.
Massimizzare l’impatto dello Spazio europeo dei dati sanitari (EHDS).
Garantire l’attuazione ottimale del Regolamento EHDS sostenendo l’accesso e la condivisione delle cartelle cliniche elettroniche e il rafforzamento delle capacità degli organismi nazionali di accesso ai dati sanitari. Si prevede che il Regolamento inizi ad essere applicato due anni dopo la sua entrata in vigore, con un’applicazione scaglionata e una prima valutazione parziale dopo otto anni. Al fine di ottimizzarne l’attuazione, è fondamentale mettere a disposizione risorse a breve termine per l’introduzione dei requisiti e degli standard dell’UE nelle cartelle cliniche elettroniche a livello nazionale. Ciò è importante soprattutto per consentire l’erogazione transfrontaliera dell’assistenza sanitaria e il diritto dei pazienti di accedere ai propri dati sanitari in un formato strutturato e interoperabile. Gli investimenti del Fondo di coesione dell’UE possono essere impiegati, integrando i consistenti investimenti nella digitalizzazione del sistema sanitario nell’ambito del Dispositivo per la ripresa e la resilienza (RRF) e del programma EU4Health. Gli organismi nazionali per l’accesso ai dati sanitari hanno un ruolo centrale, in quanto hanno il compito di decidere sulle richieste di accesso ai dati. Il loro corretto funzionamento sarà fondamentale per l’attuazione complessiva del Regolamento EHDS. Dovranno essere garantiti il chiarimento e il coordinamento a livello nazionale dei meccanismi di non partecipazione.
Fare leva sui dati sanitari esistenti per il processo decisionale normativo, politico e clinico, intensificando la standardizzazione dei dati sanitari preesistenti. Nel periodo che precede la piena applicazione del Regolamento EHDS, sarà necessario continuare e aumentare gli sforzi per standardizzare le fonti di dati esistenti verso un modello di dati comune, sulla base del lavoro avviato dallo European Health Data Evidence Network (EHDEN), che si concluderà a ottobre 2024. L’iniziativa può essere istituita come un nuovo partenariato pubblico-privato, con l’obiettivo di lavorare in pieno allineamento (compatibilità con il futuro) con l’EHDS. Grazie a questo lavoro, i dati sanitari standardizzati saranno sfruttati per generare evidenze per il processo decisionale normativo, politico e clinico.
Sfruttare la rete DARWIN EU® per generare evidenze per l’innovazione nello sviluppo dei farmaci e per le decisioni politiche e cliniche supportate dall’uso dell’IA. Le competenze e l’esperienza esistenti devono essere orientate alla generazione di prove “reali” attraverso la conduzione di studi non interventistici che attingano al catalogo di fonti di dati esistenti per espandere le attività basandosi su fonti di dati aggiuntive negli Stati membri rese disponibili dall’EHDS. L’IA ha un enorme potenziale per accelerare la gestione e l’analisi dei dati sanitari a questo scopo.
Aumentare ulteriormente le capacità di sequenziamento del genoma nell’UE e presentare un piano strategico per il periodo successivo al 2026. Sulla base dell’iniziativa europea 1+ Million Genomes (1+MG) e a complemento di Beyond 1 Million Genomes (B1MG), è necessario continuare a rafforzare l’infrastruttura per il sequenziamento dell’intero genoma, anche per migliorare la condivisione transfrontaliera dei dati nell’ambito dell’EHDS. Quest’azione, da istituire nell’ambito di un partenariato pubblico-privato, dovrebbe basarsi sull’Infrastruttura europea di dati genomici, realizzata da un progetto che si concluderà entro il 2026.
Semplificare l’impostazione e la gestione delle sperimentazioni multinazionali nell’UE.
Stabilire regole per affrontare le sfide delle sperimentazioni che combinano farmaci con dispositivi medici e l’applicazione dell’IA. Questo potrebbe seguire l’esempio delle recenti proposte di revisione delle norme sull’uso degli organismi geneticamente modificati (OGM) nelle sperimentazioni cliniche sull’uomo.
Introdurre meccanismi di coordinamento rafforzati tra i comitati etici nazionali e un comitato decisionale vincolante a livello europeo per l’autorizzazione delle sperimentazioni cliniche multinazionali. Ciò faciliterebbe la fase di avvio di nuove sperimentazioni cliniche.
Introdurre modelli in uso per le sperimentazioni, in particolare per l’interazione tra gli sponsor della sperimentazione e gli istituti partecipanti alla sperimentazione (siti), come i moduli di idoneità. Incentivare l’implementazione di modelli (compresi quelli già esistenti) come condizione per l’ottenimento di finanziamenti pubblici per le sperimentazioni cliniche. Inoltre, fornire un sostegno a livello europeo a sperimentazioni cliniche multinazionali e non commerciali può contribuire non solo a risolvere le carenze del mercato (ad esempio, la mancanza di incentivi economici per il reimpiego di farmaci non coperti da brevetto), ma anche a consolidare le competenze e le capacità all’interno dell’UE, con potenziali effetti di ricaduta sulla competitività dell’UE.
Accelerare l’accesso ai mercati attraverso un’azione coordinata delle agenzie del farmaco, delle autorità HTA e dei pagatori pubblici, al fine di emanare linee guida sulle evidenze cliniche richieste all’industria e di cooperare in materia di prezzi e rimborsi, nonché di approvvigionamento.
Razionalizzare le linee guida per l’industria sui bisogni medici non soddisfatti, la progettazione di studi clinici e l’uso di evidenze del mondo reale tra le agenzie nazionali per la medicina, gli organismi nazionali per l’HTA e le autorità per la determinazione di prezzi e rimborsi. In generale, l’interazione tra le agenzie nazionali per i medicinali e altri attori nazionali rilevanti dovrebbe essere intensificata in modo strutturato. Ciò è tanto più importante in quanto le decisioni sulla localizzazione delle attività di R&S, come le sperimentazioni cliniche di fase III con trattamenti cronici (uso ripetuto), possono essere in parte governate dalla probabilità di una successiva copertura dei farmaci da parte dei pagatori pubblici locali. In generale, si registra una tendenza a una crescente integrazione dell’intera catena del valore, a partire dalla R&S.
Superare i problemi di coordinamento tra Paesi nel settore dei prezzi e dei rimborsi. Gli Stati membri dovrebbero aderire maggiormente ai principi di determinazione dei prezzi stabiliti in precedenza nell’ambito della collaborazione EURIPID [xlvi] e intensificare le iniziative transnazionali per negoziare congiuntamente i prezzi (e i rimborsi) di farmaci specifici. Ulteriori azioni includono la necessità di valutare la possibilità di ampliare l’ambito degli appalti congiunti dell’UE per includere i trattamenti al di là di quelli in risposta alle minacce sanitarie transfrontaliere. Dato l’elevato grado di condivisione dei costi dei farmaci da parte dei pagatori pubblici nell’UE, esistono compromessi tra la stimolazione dell’innovazione, la sostenibilità fiscale e l’accesso a prezzi accessibili per i pazienti. Le azioni possono basarsi sull’esperienza e sulle competenze acquisite nella Rete delle autorità competenti in materia di fissazione dei prezzi e di rimborso (NCAPR), nonché sugli approcci collaborativi tra Paesi (come Beneluxa).
Utilizzare criteri di aggiudicazione nelle gare d’appalto pubbliche come la sicurezza dell’approvvigionamento e la produzione nell’UE/SEE o nei Paesi con cui l’UE ha concluso un accordo sugli appalti pubblici per promuovere la competitività dell’UE nel settore farmaceutico. Questa azione può basarsi su strumenti che possono già essere utilizzati in relazione alla disponibilità di farmaci essenziali, in particolare l’uso di criteri di aggiudicazione nelle gare d’appalto pubbliche, come la sicurezza dell’approvvigionamento e della produzione nell’UE/SEE o nei Paesi con cui l’UE ha concluso un accordo sugli appalti pubblici [xlvii].
Fornire indicazioni chiare e tempestive sull’uso dell’IA nel ciclo di vita dei farmaci.
Le linee guida vengono gradualmente diffuse fino al 2027 dall’EMA e dalle agenzie nazionali del farmaco, nell’ambito del proprio programma di lavoro sull’IA. Inoltre, dovrà massimizzare le possibilità offerte dal prossimo Regolamento EHDS e dalla recente Legge sull’AI. Ciò dovrebbe riguardare l’analisi dei dati clinici “grezzi” trasmessi all’EMA dall’industria, come previsto dalle attuali proposte, nonché i dati raccolti a fini di farmacovigilanza. L’apertura dell’uso secondario dei dati sanitari a fini di ricerca ha un potenziale particolare per l’ancoraggio delle attività di R&S all’interno dell’UE. L’orientamento può anche basarsi sull’esperienza acquisita attraverso la rete DARWIN EU® (cfr. proposta 1).
Attuare rapidamente e pienamente il regolamento HTA e garantire l’assegnazione delle risorse necessarie per assicurare la realizzazione di valutazioni cliniche congiunte a partire dal 2025, con l’obiettivo di istituire un’agenzia dell’UE nel lungo termine.
Il Regolamento HTA ha il potenziale per migliorare l’efficienza nell’adozione dei farmaci da parte dei sistemi sanitari dopo la loro autorizzazione all’immissione in commercio. Per raggiungere questo obiettivo dovranno essere messe a disposizione ingenti risorse. In particolare, per garantire il successo dell’attuazione delle valutazioni cliniche congiunte è necessario liberare un numero sufficiente di personale esperto degli organismi HTA nazionali e dei servizi della Commissione, nonché un finanziamento adeguato a livello europeo per gli organismi HTA. Queste valutazioni inizieranno a partire dal gennaio 2025 per i medicinali con nuove sostanze attive per il trattamento del cancro e per i medicinali per terapie avanzate. Si potrebbero prendere in considerazione modelli che consentano il recupero dei costi delle attività di HTA a livello europeo attraverso tariffe industriali. Ciò potrebbe includere la creazione di una struttura dedicata, seguendo l’esempio delle agenzie HTA a livello nazionale che sono a pagamento.
Migliorare la prevedibilità delle imprese attraverso un dialogo continuo e basato su dati concreti con le parti interessate per sostenere il processo decisionale dell’UE sui meccanismi di protezione dei nuovi farmaci.
L’UE vanta un quadro solido e trasparente per la protezione della proprietà intellettuale, anche attraverso regimi di protezione regolamentari. La proprietà intellettuale è il motore principale dell’innovazione medica a livello globale. Dati i lunghi tempi di sviluppo dei farmaci, è necessaria una stabilità negli incentivi offerti da questo quadro. Allo stesso tempo, i mercati farmaceutici sono dinamici, guidati dagli sviluppi scientifici. Il loro funzionamento competitivo si evolve in parallelo, il che implica la possibilità di modifiche future a questo quadro.
Per migliorare la trasparenza delle motivazioni a lungo termine dell’azione politica dell’UE, quest’ultima dovrebbe sviluppare, pubblicizzare e aggiornare costantemente un modello standard che catturi gli impatti principali dell’azione normativa dell’UE in termini di innovazione e accesso dei pazienti. L’ispirazione può venire dall’esperienza statunitense e dal recente Congressional Budget Office Model of New Drug Development. In questo modo, insieme al coinvolgimento continuo delle parti interessate, i futuri sviluppi dell’acquis farmaceutico dell’UE vengono posti su una solida base.
Aumentare e concentrare gli investimenti pubblici in R&S nell’UE.
Concentrare i finanziamenti dell’UE sullo sviluppo di un numero limitato di hub di innovazione di livello mondiale nelle scienze della vita per i medicinali per terapie avanzate (ATMP). Si possono trarre lezioni dall’esempio del California Institute for Regenerative Medicine (CIRM) come modello per la creazione di un istituto leader nell’UE dedicato al progresso della terapia con cellule staminali. Fondato nel 2004, con un budget annuale di 423 milioni di dollari (anno fiscale 2022-2023), il CIRM finanzia sperimentazioni cliniche, offre formazione e ospita gruppi di lavoro per consigliare i ricercatori su come accelerare lo sviluppo di terapie. Ad oggi, più di 50 start-up hanno origine da progetti di ricerca finanziati dal CIRM. Le caratteristiche uniche del CIRM, oltre alla sua particolare attenzione allo sviluppo di terapie a base di cellule staminali, comprendono l’esplicito mandato di finanziare infrastrutture (l’Alpha Clinics Network) e il coinvolgimento di enti regolatori e pagatori nelle sue attività. Nell’UE sono nate iniziative promettenti, come il Centro di terapia genica e cellulare istituito presso l’ospedale Charité di Berlino. Occorre individuare in tutta l’UE un maggior numero di centri di eccellenza e di innovazione nelle scienze della vita e consolidarli con il sostegno pubblico dell’UE, in linea con la Piattaforma per le tecnologie strategiche per l’Europa (STEP) per le biotecnologie [si veda il capitolo sull’innovazione di questo documento].
Espandere, consolidare e integrare i registri delle malattie istituiti nell’ambito delle Reti di riferimento europee (ERN). Le ERN sono state istituite per la prima volta nel 2017 come reti virtuali che coinvolgono gli operatori sanitari di tutta Europa. Il loro scopo è quello di facilitare le discussioni su malattie e condizioni complesse o rare che richiedono trattamenti altamente specializzati, conoscenze e risorse concentrate. Le ERN sono coinvolte nella gestione di grandi studi clinici multicentrici, con particolare attenzione alle malattie rare e alle aree di nicchia del know-how scientifico. Un esempio rilevante è il gruppo di lavoro sulle cellule staminali e la terapia genica istituito nell’ambito della RITA – l’ERN che si occupa di pazienti con disturbi immunologici rari. Il finanziamento di base per le ERN attinge al programma EU4Health (le sovvenzioni ammontano a 7,8, 11,2 e 77,2 milioni di euro nell’ambito del programma di lavoro rispettivamente negli anni 2021, 2022 e 2023). L’azione volta a rafforzare l’utilizzabilità dei dati dei pazienti raccolti nell’ambito degli ERN, nonché l’integrazione con l’EHDS, probabilmente favorirà la ricerca e lo sviluppo di farmaci orfani nell’UE.
Mobilitare gli investimenti privati in R&S nell’UE e rafforzare l’ambiente di sostegno.
In linea con la proposta contenuta nel capitolo sull’innovazione, si raccomanda di aumentare il bilancio del Fondo europeo per gli investimenti (FEI) per migliorare l’ecosistema del capitale di rischio dell’UE. Per i prodotti farmaceutici, in particolare, si potrebbe sfruttare l’esperienza acquisita con l’attuale programma di debito di rischio per le PMI e le imprese a media capitalizzazione con un’attenzione specifica alle scienze della vita.
Inoltre, in linea con la proposta contenuta nel capitolo Sostegno agli investimenti, il programma InvestEU potrebbe finanziare investimenti a più alto rischio e a maggiore scalabilità. Ciò è in linea con la possibilità che la BEI attinga a capitali di crescita in fase avanzata nell’ambito della European Tech Champions Initiative (ETCI), lanciata nel febbraio 2023. In questo modo si affronterebbe il fatto che, accanto a un finanziamento di private equity complessivamente più basso per le biotecnologie nell’UE rispetto agli Stati Uniti, le dimensioni medie delle operazioni sono segnalate come significativamente inferiori.
Sviluppare partenariati internazionali strategici per consolidare e rafforzare la posizione commerciale internazionale dell’UE nel settore farmaceutico.
Le misure adottate per rafforzare la resilienza delle catene di approvvigionamento farmaceutico nell’UE si concentrano sull’attenuazione delle carenze di farmaci critici, la maggior parte dei quali non è coperta da brevetto. Tuttavia, tali misure hanno anche il potenziale per aumentare la competitività complessiva dell’industria. Ciò riguarda in particolare la produzione di biologici nell’UE, in quanto le aziende che lanciano i biologici con brevetto lanciano sempre più spesso anche i biosimilari. I possibili effetti negativi indiretti di tali misure sulla posizione commerciale dell’UE possono essere ridotti al minimo integrandoli con la diversificazione degli scambi. Ciò potrebbe comprendere la cooperazione internazionale al fine di rafforzare l’autonomia della resilienza dell’approvvigionamento, in particolare attraverso la diversificazione delle catene di approvvigionamento e lo sviluppo di nuovi siti produttivi in regioni strategiche al di fuori dell’UE, il rafforzamento delle fonti di approvvigionamento esistenti, lo sviluppo di partenariati strategici con partner internazionali e l’ottimizzazione degli accordi commerciali. L’Alleanza per i medicinali critici riunisce membri dell’UE ed extra-UE per affrontare queste sfide e trovare soluzioni per rafforzare le catene globali di approvvigionamento dei farmaci. Si sta procedendo anche in altre sedi.
Tabella delle Abbreviazioni
1+MG 1+ Million Genomes ACT EU Accelerazione delle sperimentazioni cliniche nell’UE API Principio attivo ATMP Medicinale per terapia avanzata B1MG Beyond 1 Million Genomes BARDA Agenzia per la ricerca e lo sviluppo avanzati in campo biomedico BEI Banca europea per gli investimenti CAGR Tasso di crescita annuo composto CIRM California Institute for Regenerative Medicine CTIS Sistema informativo sulle sperimentazioni cliniche DARWIN EU® Data Analysis and Real World Interrogation Network EHDEN European Health Data Evidence Network EHDS Spazio Europeo dei Dati Sanitari EMA Agenzia europea per i medicinali ERN Rete di riferimento europea ETCI European Tech Champions Initiative FDA Food and Drug Administration GBARD Stanziamenti pubblici per la ricerca e lo sviluppo GDPR Regolamento generale sulla protezione dei dati HERA Autorità europea per la preparazione e la risposta alle emergenze sanitarie HTA Valutazione delle tecnologie sanitarie IA Intelligenza artificiale INSERM Istituto nazionale per la sanità e la ricerca medica NCAPR Rete delle autorità competenti in materia di fissazione dei prezzi e di rimborso NIH National Institute of Health OGM Organismo geneticamente modificato P&R Determinazione di prezzi e rimborsi R&S Ricerca e sviluppo RRF Dispositivo per la ripresa e la resilienza STEP Piattaforma per le tecnologie strategiche per l’Europa TFEU Trattato sul funzionamento dell’Unione europea
Note bibliografiche
- Commissione europea (CCR), The 2023 EU Industrial R&D Investment Scoreboard, Allegato dati, 2023.
- IQVIA, The Global Use of Medicines 2023, 2023.
- Commissione europea, Eurostat, National accounts aggregates by industry (up to NACE A*64) (online data code: nama_10_a64), consultato il data 19 luglio 2024.
- Commissione europea, Eurostat, International trade in medicinal and pharmaceutical products, consultato il 31 maggio 2024.
- Commissione europea, Eurostat, Employment by sex, age and detailed economic activity (from 2008 onwards, NACE Rev. 2 two digit level) – 1 000 (Online data code: lfsq_egan22d), consultato il 31 maggio 2024.
- PWC e la Federazione europea delle associazioni delle industrie farmaceutiche (EFPIA), Economic and societal footprint of the pharmaceutical industry in Europe, 2019, p.6 (figura 2).
- EFPIA, The Pharmaceutical Industry in Figures, 2024, p. 7.
- EFPIA, EU strategic resilience in pharmaceuticals: global value chains and innovation, 2020.
- European Centre for International Political Economy (ECIPE), Key Trade Data Points on the EU27 Pharmaceutical Supply Chain, 2020.
- IQVIA, IQVIA Midas® quarterly volume sales data for period 2012- 2022 (dati proprietari forniti dalla Commissione europea).
- Idem.
- IQVIA, Piping Hot: A look at the state of cell, gene and RNA therapies in early 2023, 2023.
- Commissione europea, Eurostat, GBARD by socioeconomic objectives (NABS 2007), (Online data code:gba_nabsfin07), consultato il 31 maggio 2024.
- Commissione europea, Eurostat, GERD by sector of performance and source of funds´ (online data code: rd_e_gerdfund), consultato il 31 maggio 2024.
- Diao, Y. et al., `Unlocking Access To Novel Medicines In China-A Review From A Health System Perspective´, Risk Management and Healthcare Policy, (12), 2019.
- Commissione europea, Eurostat, GBARD by socioeconomic objectives (NABS 2007) (online data code: gba_nabsfin07), consultato il 31 maggio 2024.
- Idem.
- Ge, Q. et al., “Development of Chinese innovative drugs in the USA”, nature reviews drug discovery biobusiness briefs, 8 maggio 2024.
- Gong, J. et al., “Bridging the gap between innovation and later-stage financing for biotech in Europe”, nature reviews drug discovery biobusiness briefs, 5 settembre 2023.
- IQVIA, Emerging Biopharma’s Contribution to Innovation, 2022.
- OCSE, BERD by industry, consultato il 31 maggio 2024.
- EFPIA, op. cit., 2024.
- Piovesan, L. et al., “Challenges and Opportunities in Biotherapies and Bioproduction – an EIB Investment Perspective”, Réalités Industrielles, novembre 2023.
- Charles Rivers Associates, Factors affecting the location of biopharmaceutical investments and implications for European policy priorities, 2022, p. 58.
- EFPIA, op cit., 2024.
- Commissione europea, Centro comune di ricerca, The 2023 EU Industrial R&D Investment Scoreboard, allegato dati, 2023.
- Defever, F., “Functional fragmentation and the location of multinational firms in the enlarged Europe”, Regional Science and Urban Economics, Volume 36, Issue 5, settembre 2006.
- Piovesan, L. et al., op. cit., 2023.
- Centre for Innovation in Regulatory Science (CIRS), New drug approvals in six major authorities 2013-2022: Focus on orphan designation and facilitated regulatory pathways, 2023, p. 1.
- Commissione europea, Impact Assessment Pharma Review Proposal, allegato 5, 2023, p. 54.
- Dipartimento della Salute e dei Servizi Umani degli Stati Uniti (HHS) (HHS), Comparing New Prescription Drug Availability and Launch Timing in the United States and Other OECD Countries, 2024 p. 5.
- Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWIQ), The AMNOG procedure: more than just cost control, 2024.
- Pharmaceutical pricing and Reimbursement Information (PPRI), PPRI Pharma profile Sweden, 2023.
- OCSE, Health at a Glance, 2023, figura 2.3 a p. 41.
- Commissione europea, Domande frequenti sulla revisione della legislazione farmaceutica, 2023.
- Commissione europea, The Combine Project, 2024.
- Data Analysis and Real World Interrogation Network (DARWIN EU®), listed studies, consultato il 31 maggio 2024.
- Commissione europea, European ‘1+ Million Genomes’ Initiative, 2024.
- Gloriumtech, The potential for AI in healthcare, 2024.
- Haug, C. J. et al. 2023, “Artificial Intelligence and Machine Learning in Clinical Medicine, 2023”, N Engl J Med 2023; 388.
- Murphy, E.A. et al., `Machine learning outperforms clinical experts in classification of hip fractures´, Nature Scientific Reports volume 12, numero articolo: 2058, 2022.
- Boston Consulting Group, Unlocking the potential of AI in Drug Discovery, 2023, p. 6.
- Data Analysis and Real World Interrogation Network (DARWIN EU®), op. cit., 2024.
- McKinsey, Generative AI in the pharmaceutical industry: Moving from hype to reality, 2024.
- OMS, Benefits and risks of using artificial intelligence for pharmaceutical development and deliver, 2024, p.19.
- European medicine price database (EURIPID), Best practice report on External Reference Pricing (ERP), 2017.
- Commissione europea, Communication from the Commission to the European Parliament, the Council, the European Economic and Social Committee and the Committee of the Regions – Addressing medicine shortages in the EU (COM(2023) 672 final), 2023.
